나녹스, 싱글소스 디지털 엑스레이 기술 美 FDA 510(k) 허가 획득
동아닷컴 김민범 기자
입력 2021-04-05 15:40 수정 2021-04-05 15:45
“기존 장비 대체 가능한 기술력 입증받은 것”
판매 관련 시판 전 허가 획득 추진

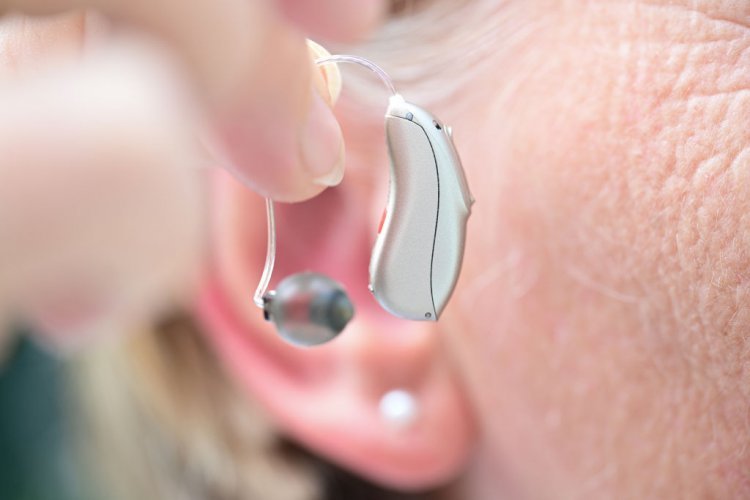
영상진단 기술업체 나녹스(NANO-X IMAGING)는 지난 2일(현지시간) 싱글소스 나녹스아크 디지털 엑스레이 기술이 미국 식품의약국(FDA)로부터 510(k) 허가(Clearance)를 받았다고 발표했다. 싱글소스에 이어 올해 멀티소스 나녹스아크와 나녹스클라우드의 FDA 승인을 추진할 계획이라고 한다.
나녹스에 따르면 이번 510(k) 허가는 의료기기를 대상으로 기술 신뢰도를 평가하는 절차다. 이를 통해 기존 엑스레이 장비를 대체할 수 있는 기술력을 입증했다고 강조했다. 제품 판매를 위해서는 시판 전 허가 절차를 추가로 거쳐야 한다.
폴리아킨 나녹스 회장 겸 CEO는 “이번 허가를 획득해 미국 내 규제승인 계획의 중요한 진전을 이뤘다”며 “올해는 나녹스아크 시스템 초기배치를 시작해 오는 2024년 배치를 완료할 계획”이라고 말했다.
한편 나녹스는 냉음극 기반 디지털 엑스레이 기술을 통해 의료 관련 영상진단장비 소형화와 대중화를 추진하는 업체다.
동아닷컴 김민범 기자 mbkim@donga.com
판매 관련 시판 전 허가 획득 추진

영상진단 기술업체 나녹스(NANO-X IMAGING)는 지난 2일(현지시간) 싱글소스 나녹스아크 디지털 엑스레이 기술이 미국 식품의약국(FDA)로부터 510(k) 허가(Clearance)를 받았다고 발표했다. 싱글소스에 이어 올해 멀티소스 나녹스아크와 나녹스클라우드의 FDA 승인을 추진할 계획이라고 한다.
나녹스에 따르면 이번 510(k) 허가는 의료기기를 대상으로 기술 신뢰도를 평가하는 절차다. 이를 통해 기존 엑스레이 장비를 대체할 수 있는 기술력을 입증했다고 강조했다. 제품 판매를 위해서는 시판 전 허가 절차를 추가로 거쳐야 한다.
폴리아킨 나녹스 회장 겸 CEO는 “이번 허가를 획득해 미국 내 규제승인 계획의 중요한 진전을 이뤘다”며 “올해는 나녹스아크 시스템 초기배치를 시작해 오는 2024년 배치를 완료할 계획”이라고 말했다.
한편 나녹스는 냉음극 기반 디지털 엑스레이 기술을 통해 의료 관련 영상진단장비 소형화와 대중화를 추진하는 업체다.
동아닷컴 김민범 기자 mbkim@donga.com
비즈N 탑기사
 김숙 “내 건물서 거주+월세 수입 생활이 로망”
김숙 “내 건물서 거주+월세 수입 생활이 로망” “20억 받으면서 봉사라고?”…홍명보 감독 발언에 누리꾼 ‘부글’
“20억 받으면서 봉사라고?”…홍명보 감독 발언에 누리꾼 ‘부글’ 세계적 유명 모델이 왜 삼성역·편의점에…“사랑해요 서울” 인증샷
세계적 유명 모델이 왜 삼성역·편의점에…“사랑해요 서울” 인증샷 “사람 치아 나왔다” 5000원짜리 고기 월병 먹던 中여성 ‘경악’
“사람 치아 나왔다” 5000원짜리 고기 월병 먹던 中여성 ‘경악’ “모자로 안가려지네”…박보영, 청순한 미모로 힐링 여행
“모자로 안가려지네”…박보영, 청순한 미모로 힐링 여행- 엄마 편의점 간 사이 ‘탕’…차에 둔 권총 만진 8살 사망
- 8시간 후 자수한 음주 뺑소니 가해자…한문철 “괘씸죄 적용해야”
- 교보생명, 광화문글판 가을편 새단장…윤동주 ‘자화상’
- 힐러리 “내가 못 깬 유리천장, 해리스가 깨뜨릴 것”
- ‘SNS 적극 활동’ 고현정…“너무 자주 올려 지겨우시실까봐 걱정”
 14조 들인 에틸렌 생산 설비 착착… “신기술로 中 저가공세 깬다”
14조 들인 에틸렌 생산 설비 착착… “신기술로 中 저가공세 깬다” K방산 영업익 200%대 증가 예고… 실적잔치 기대감
K방산 영업익 200%대 증가 예고… 실적잔치 기대감 기업 실적 ‘최악’… 10곳중 4곳, 영업이익으로 이자도 못내
기업 실적 ‘최악’… 10곳중 4곳, 영업이익으로 이자도 못내 ‘공사비 갈등’ 둔촌주공 재건축 25일 공사 재개.. 조합, 210억 증액 수용
‘공사비 갈등’ 둔촌주공 재건축 25일 공사 재개.. 조합, 210억 증액 수용 넷플릭스發 ‘제작비 인플레’… 흥행작 제작사도 “쇼트폼 갈아탈 판”
넷플릭스發 ‘제작비 인플레’… 흥행작 제작사도 “쇼트폼 갈아탈 판”- 올해 韓 경제 2.6% 성장 여부 안갯속…정부 “불확실성 커 수정 불가피”
- 금감원 압박에… 은행 대출규정 석달새 21회 강화
- 합병 앞둔 SK이노, 계열사 사장 3명 교체… 기술형 리더 발탁
- ‘美 공급망 재편 수혜’ 인도 주식에 올해 국내 자금 1.2조 몰려
- “롯데百의 미래 ‘타임빌라스’에 7조 투자, 국내 쇼핑몰 1위로”


















![재건축 단지에 현황용적률 인정… 사업성 증가 효과[부동산 빨간펜] 재건축 단지에 현황용적률 인정… 사업성 증가 효과[부동산 빨간펜]](https://dimg.donga.com/a/102/54/90/1/wps/ECONOMY/FEED/BIZN_REALESTATE/130291012.2.thumb.jpg)