종근당, 2세대 빈혈치료제 ‘CKD-11101’ 일본 판매 승인 신청
동아닷컴 김민범 기자
입력 2018-10-05 10:53 수정 2018-10-05 10:59
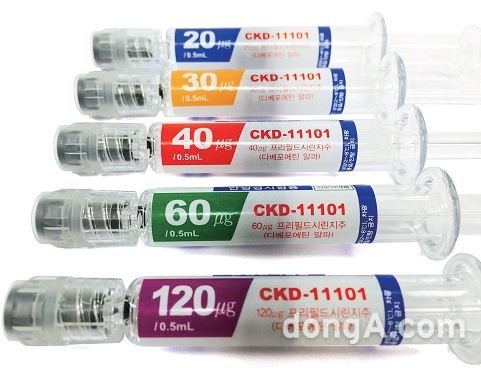
종근당은 2세대 빈혈치료제 바이오시밀러(유사 복제약) ‘CKD-11101’의 일본 내 제조판매를 위한 승인 신청을 후생노동성에 접수했다고 5일 밝혔다. CKD-11101은 지난 1일부터 일본에 수출이 시작됐다.
앞서 종근당은 미국 브랜드 제약회사 일본법인과 치료제 유통 허가를 위한 임상시험 진행과 제품허가, 제품 독점 판매 등에 대한 계약을 체결한 바 있다. 후생노동성으로부터 제조판매 승인을 받게 되면 종근당은 치료제 완제품을 미국회사 일본법인에 수출하고 이 법인은 현지 판매를 담당하게 된다. 미국회사 이름은 계약 상 노출할 수 없다고 종근당 관계자는 전했다.
CKD-11101은 다베포에틴 알파(Darbepoetin α)를 주성분으로 하는 네스프(원조 빈혈치료제) 바이오시밀러로 만성신부전 환자 빈혈치료에 효과적인 약물이다. 지난해 국내에서 임상시험을 마치고 식품의약안전처에 품목 허가를 신청했으며 올해 승인을 목표로 하고 있다. 식약처 승인이 완료되면 이 치료제는 종근당의 첫 번째 바이오의약품이면서 세계 최초의 네스프 바이오시밀러로 출시될 전망이다.
종근당 관계자는 “약 5000억 원 규모를 형성하고 있는 일본 네스프 시장에서 CKD-11101이 성공적으로 출시되고 시장을 확대할 수 있도록 미국 브랜드 일본법인과 협력을 강화할 것”이라며 “일본 시장을 바탕으로 향후 3조 원 규모 글로벌 네스프·아라네스프 시장에도 진출할 수 있을 것으로 기대한다”고 말했다.
한편 종근당은 CKD-11101 외에 지속형 단백질과 항체의약품 바이오시밀러와 바이오신약을 개발 중이다. 4조 원대 글로벌 시장을 형성하고 있는 황반변성 항체의약품 루센티스 바이오시밀러 ‘CKD-701’이 최근 식챡처로부터 임상 3상을 승인받아 서울대병원과 서울아산병원, 삼성서울병원 등 국내 25개 기관에서 임상시험을 진행할 예정이다. 항암이중항체 바이오신약 ‘CKD-702’는 범부처신약개발사업단 지원과제로 선정돼 전 임상 단계에 있다. 개발이 성공할 경우 기존 표적항암제 내성과 단점을 극복할 수 있는 혁신 신약이 될 것으로 예상된다.
동아닷컴 김민범 기자 mbkim@donga.com
비즈N 탑기사
 ‘책 출간’ 한동훈, 정계 복귀 움직임에 테마株 강세
‘책 출간’ 한동훈, 정계 복귀 움직임에 테마株 강세 조선 후기 화가 신명연 ‘화훼도 병풍’ 기념우표 발행
조선 후기 화가 신명연 ‘화훼도 병풍’ 기념우표 발행 붕괴 교량과 동일·유사 공법 3곳 공사 전면 중지
붕괴 교량과 동일·유사 공법 3곳 공사 전면 중지 명동 ‘위조 명품’ 판매 일당 덜미…SNS로 관광객 속였다
명동 ‘위조 명품’ 판매 일당 덜미…SNS로 관광객 속였다 “나대는 것 같아 안올렸는데”…기안84 ‘100 챌린지’ 뭐길래
“나대는 것 같아 안올렸는데”…기안84 ‘100 챌린지’ 뭐길래- ‘전참시’ 이연희, 득녀 5개월만 복귀 일상…아침 산책+운동 루틴
- 국내 기술로 개발한 ‘한국형 잠수함’ 기념우표 발행
- ‘아파트 지하주차장서 음주운전’ 인천시의원 송치
- 학령인구 감소 탓에 도심지 초교마저 학급 편성 ‘비상’
- 상속인 행세하며 100억 원 갈취한 사기꾼 일당 붙잡혀
 강남 재건축 아파트 3.3㎡당 1억 넘어
강남 재건축 아파트 3.3㎡당 1억 넘어 설 명절 다가오는데…고환율에 수입 과일·수산물 가격도 부담
설 명절 다가오는데…고환율에 수입 과일·수산물 가격도 부담 쿠팡 보상쿠폰, 알고보니 석달짜리… 치킨-커피 상품권도 못 사
쿠팡 보상쿠폰, 알고보니 석달짜리… 치킨-커피 상품권도 못 사 7500원 두쫀쿠, 재료비만 2940원…“비싼 이유 있었다”
7500원 두쫀쿠, 재료비만 2940원…“비싼 이유 있었다” “사천피 뚫린 국장의 반란”…동학개미 작년 수익률, 서학개미의 ‘3배’
“사천피 뚫린 국장의 반란”…동학개미 작년 수익률, 서학개미의 ‘3배’- 개인 ‘반도체 투톱’ 올들어 4조 순매수… 주가 급등에 ‘반포개미’도
- 김밥·붕어빵·호두과자까지…두쫀쿠 변형 메뉴 잇따라
- 탈팡에 주문량 뚝…쿠팡 물류 무급휴직 5000명 넘었다
- “좁아도 강남” 10평대도 신고가…17평 아파트 19억 찍었다
- ‘호화 출장’ 강호동 농협회장 대국민사과… ‘3억 추가 연봉’ 농민신문사 겸직도 사임









![토허제 없는 경매시장, 올해도 강세[이주현의 경매 길라잡이] 토허제 없는 경매시장, 올해도 강세[이주현의 경매 길라잡이]](https://dimg.donga.com/a/102/54/90/1/wps/ECONOMY/FEED/BIZN/133168606.2.thumb.jpg)




![토허제 없는 경매시장, 올해도 강세[이주현의 경매 길라잡이] 토허제 없는 경매시장, 올해도 강세[이주현의 경매 길라잡이]](https://dimg.donga.com/a/102/54/90/1/wps/ECONOMY/FEED/BIZN_REALESTATE/133168606.2.thumb.jpg)


![[시승기] 제주에서 느끼는 드라이빙의 즐거움…‘포르쉐 올레 드라이브’ [시승기] 제주에서 느끼는 드라이빙의 즐거움…‘포르쉐 올레 드라이브’](https://dimg.donga.com/wps/ECONOMY/FEED/BIZN_FEED_EVLOUNGE/132703912.2.thumb.jpg)