삼성바이오에피스 ‘SB5’, 美FDA에 판매허가 신청
황성호 기자
입력 2018-09-28 03:00
관절염 등 치료 ‘휴미라’ 복제약, 2023년 6월 美시장 출시 예정
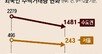
삼성바이오에피스는 미국 식품의약국(FDA)에 자사의 바이오 복제약(바이오시밀러) ‘SB5’ 판매 허가를 신청했다고 27일 밝혔다. SB5는 자가면역질환 치료제인 ‘휴미라’의 바이오시밀러다. 휴미라는 미국 시장에서만 지난해 13조 원어치가 팔린 치료제다.
삼성바이오에피스에 따르면 FDA는 SB5에 대한 품목 허가 절차를 21일 시작했다. 이는 삼성바이오에피스가 7월 FDA에 제출한 SB5의 허가 신청 서류에 대한 사전 검토가 완료된 데 따른 것이다. 품목 허가 심사는 통상 12∼15개월가량 걸린다.
휴미라는 미국의 글로벌 제약사인 애브비에서 개발한 자가면역질환 치료제로 주로 류머티스 관절염, 궤양성 대장염 질환 치료제로 쓰인다. 지난해 글로벌 시장 매출이 20조 원을 넘었다. 전 세계 판매 1위 바이오의약품인 만큼 2016년 말 휴미라 성분물질에 대한 특허 기간이 끝나자 글로벌 제약사들은 대거 바이오시밀러 개발에 뛰어들었다.
삼성바이오에피스는 미국 식품의약국(FDA)에 자사의 바이오 복제약(바이오시밀러) ‘SB5’ 판매 허가를 신청했다고 27일 밝혔다. SB5는 자가면역질환 치료제인 ‘휴미라’의 바이오시밀러다. 휴미라는 미국 시장에서만 지난해 13조 원어치가 팔린 치료제다.
삼성바이오에피스에 따르면 FDA는 SB5에 대한 품목 허가 절차를 21일 시작했다. 이는 삼성바이오에피스가 7월 FDA에 제출한 SB5의 허가 신청 서류에 대한 사전 검토가 완료된 데 따른 것이다. 품목 허가 심사는 통상 12∼15개월가량 걸린다.
휴미라는 미국의 글로벌 제약사인 애브비에서 개발한 자가면역질환 치료제로 주로 류머티스 관절염, 궤양성 대장염 질환 치료제로 쓰인다. 지난해 글로벌 시장 매출이 20조 원을 넘었다. 전 세계 판매 1위 바이오의약품인 만큼 2016년 말 휴미라 성분물질에 대한 특허 기간이 끝나자 글로벌 제약사들은 대거 바이오시밀러 개발에 뛰어들었다.
삼성바이오에피스는 2012년부터 휴미라의 처방을 대신할 수 있는 바이오시밀러 개발에 나섰다. 삼성바이오에피스는 애브비와 합의해 미국 시장에서 2023년 6월부터 SB5를 판매할 수 있다. 휴미라를 만드는 성분물질 외에 다른 부분의 특허권은 끝나지 않아 협의가 필요했다. 삼성바이오에피스 관계자는 “암젠과 베링거인겔하임 등 글로벌 제약사들도 휴미라의 바이오시밀러 판매를 시작할 예정인 만큼 미국 시장에서 치열한 경쟁이 예상된다”고 말했다. 유럽에서는 지난해 8월 SB5의 판매 허가를 받아 다음 달부터 판매를 시작한다. 유럽 현지 제품명은 ‘임랄디’다.
황성호 기자 hsh0330@donga.com
















![[시승기] 제주에서 느끼는 드라이빙의 즐거움…‘포르쉐 올레 드라이브’ [시승기] 제주에서 느끼는 드라이빙의 즐거움…‘포르쉐 올레 드라이브’](https://dimg.donga.com/wps/ECONOMY/FEED/BIZN_FEED_EVLOUNGE/132703912.2.thumb.jpg)