식약처, 인보사 회수폐기 명령… 허가취소 후속조치
뉴시스
입력 2019-07-11 11:43 수정 2019-07-11 11:43
코오롱생명과학, 불복 행정소송 제기
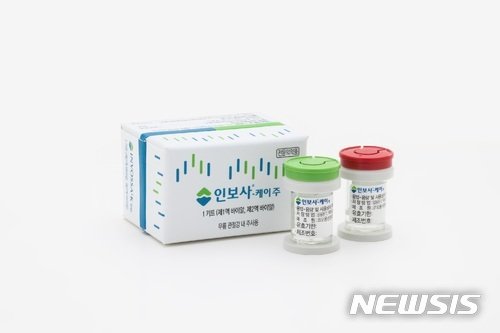
식품의약품안전처가 인보사 품목허가 취소의 후속 조치로 제품 회수폐기를 명령했다.
식약처는 11일 “허가받은 내용과 달리 안전성·유효성이 충분히 확보되지 않았다”며 인보사케이주 회수·폐기를 공고했다. 이 공고는 오는 2022년 7월10일까지 게재된다.
앞서 식약처는 지난 3일 코오롱생명과학의 골관절염 유전자치료제 인보사케이주의 허가를 취소했다.
인보사는 연골세포가 담긴 1액과 연골세포 성장인자(TGF-β1)를 도입한 형질 전환 세포가 담긴 2액으로 구성된 유전자 치료제다. 지난 2017년 7월 허가받았다.
하지만 미국 검사법에 맞춰 제품을 조사하던 중 올 3월 2액의 정체가 연골세포가 아닌 종양 유발 가능성이 있는 신장세포로 밝혀지면서 결국 품목허가가 취소됐다 .
현재 코오롱생명과학은 허가 취소 및 회수·폐기 조치에 불복하며, 행정소송을 제기한 상황이다.
소장에서 불복한 내용은 ▲품목허가 취소 ▲임상시험 계획승인 취소 ▲인보사 회수·폐기 명령 등이다.
【서울=뉴시스】

식품의약품안전처가 인보사 품목허가 취소의 후속 조치로 제품 회수폐기를 명령했다.
식약처는 11일 “허가받은 내용과 달리 안전성·유효성이 충분히 확보되지 않았다”며 인보사케이주 회수·폐기를 공고했다. 이 공고는 오는 2022년 7월10일까지 게재된다.
앞서 식약처는 지난 3일 코오롱생명과학의 골관절염 유전자치료제 인보사케이주의 허가를 취소했다.
인보사는 연골세포가 담긴 1액과 연골세포 성장인자(TGF-β1)를 도입한 형질 전환 세포가 담긴 2액으로 구성된 유전자 치료제다. 지난 2017년 7월 허가받았다.
하지만 미국 검사법에 맞춰 제품을 조사하던 중 올 3월 2액의 정체가 연골세포가 아닌 종양 유발 가능성이 있는 신장세포로 밝혀지면서 결국 품목허가가 취소됐다 .
현재 코오롱생명과학은 허가 취소 및 회수·폐기 조치에 불복하며, 행정소송을 제기한 상황이다.
소장에서 불복한 내용은 ▲품목허가 취소 ▲임상시험 계획승인 취소 ▲인보사 회수·폐기 명령 등이다.
【서울=뉴시스】
비즈N 탑기사
 백일 아기 비행기 좌석 테이블에 재워…“꿀팁” vs “위험”
백일 아기 비행기 좌석 테이블에 재워…“꿀팁” vs “위험” 최저임금 2만원 넘자 나타난 현상…‘원격 알바’ 등장
최저임금 2만원 넘자 나타난 현상…‘원격 알바’ 등장 “배우자에게 돈 보냈어요” 중고거래로 명품백 먹튀한 40대 벌금형
“배우자에게 돈 보냈어요” 중고거래로 명품백 먹튀한 40대 벌금형 이렇게 63억 건물주 됐나…김지원, 명품 아닌 ‘꾀죄죄한’ 에코백 들어
이렇게 63억 건물주 됐나…김지원, 명품 아닌 ‘꾀죄죄한’ 에코백 들어 상하이 100년간 3m 침식, 中도시 절반이 가라앉고 있다
상하이 100년간 3m 침식, 中도시 절반이 가라앉고 있다- 김지훈, 할리우드 진출한다…아마존 ‘버터플라이’ 주연 합류
- “도박자금 마련하려고”…시험장 화장실서 답안 건넨 전직 토익 강사
- 몸 속에 거즈 5개월 방치…괄약근 수술 의사 입건
- 일본 여행시 섭취 주의…이 제품 먹고 26명 입원
- “1인 안 받는 이유 있었네”…식탁 위 2만원 놓고 간 손님 ‘훈훈’
 1인 가구 공공임대 ‘면적 축소’ 논란…국토부 “면적 기준 폐지 등 전면 재검토”
1인 가구 공공임대 ‘면적 축소’ 논란…국토부 “면적 기준 폐지 등 전면 재검토” 삼성, 세계 첫 ‘올인원 AI PC’ 공개
삼성, 세계 첫 ‘올인원 AI PC’ 공개 “인구감소로 집값 떨어져 노후 대비에 악영향 줄수도”
“인구감소로 집값 떨어져 노후 대비에 악영향 줄수도” [머니 컨설팅]사적연금 받을 때 세금 유불리 따져봐야
[머니 컨설팅]사적연금 받을 때 세금 유불리 따져봐야 “만원으로 밥 먹기 어렵다”…평균 점심값 1만원 첫 돌파
“만원으로 밥 먹기 어렵다”…평균 점심값 1만원 첫 돌파- 고금리-경기침체에… 개인회생 두달새 2만2167건 역대 최다
- “한국판 마리나베이샌즈 막는 킬러규제 없애달라”
- 직장인 1000만명 이달 월급 확 준다…건보료 ‘20만원 폭탄’
- 엘리베이터 호출서 수령자 인식까지… ‘배송 로봇’ 경쟁 본격화
- 연체 채권 쌓인 저축銀, 영업 축소… 수신잔액 26개월만에 최저











![[단독]삼성전자 900명, 연봉 5.1% 인상 거부… 계열 7곳, 노사현황 긴급보고 [단독]삼성전자 900명, 연봉 5.1% 인상 거부… 계열 7곳, 노사현황 긴급보고](https://dimg.donga.com/a/102/54/90/1/wps/ECONOMY/FEED/BIZN/124623558.2.thumb.jpg)