셀트리온, ‘허쥬마’ 브라질 판매허가 승인…중남미 시장 공략 가속화
동아닷컴 김민범 기자
입력 2019-05-22 17:17 수정 2019-05-22 17:34
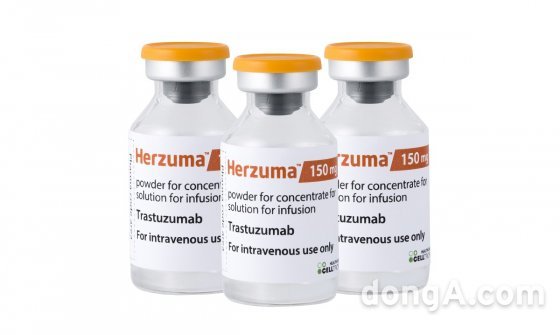
셀트리온은 지난 20일(현지 시간) 브라질 국가위생감시국(ANVISA)으로부터 유방암·위암 치료용 항체 바이오시밀러 ‘허쥬마(개발명 CT-P6, 성분명 트라스트주맙)’ 판매 허가를 받았다고 22일 밝혔다. 브라질 당국은 조기유방암과 전이성유방암, 전이성위암 등 허쥬마 전체 적응증에 대해 150mg과 440mg 용량을 모두 승인했다.
허쥬마 오리지널의약품은 제넨텍(Genentech)이 개발하고 로슈(Roche)가 판매하는 ‘허셉틴’이다. 브라질에서 연간 약 3000억 원 규모 시장을 형성하고 있는 것으로 알려졌다. 셀트리온은 허쥬마 현지 진출을 위해 계열사인 셀트리온헬스케어와 대외 비즈니스 상황을 고려해 전략적으로 론칭 시점을 결정한다는 방침이다.
특히 약 5200억 원 규모 중남미 전체 허셉틴 바이오시밀러 시장에서 브라질은 절반이 넘는 비중을 차지하는 주요 거점으로 전해졌다. 셀트리온은 브라질 시장을 교두보로 삼아 전체 중남미 시장 진출과 론칭 국가를 확대해 나간다는 전략이다.
중남미 전체 기준 약 2500억 원 규모 혈액암 치료용 리툭시맙 시장 진출도 추진한다. 셀트리온에 따르면 브라질 국가위생감시국이 바이오시밀러 ‘트룩시마’에 대한 허가 심사를 마무리 할 것으로 예상된다. 이에 따라 램시마-허쥬마와 더불어 중남미 바이오시밀러 시장 공략이 한층 가속화될 전망이라고 전했다.
브라질은 자국에서 사용되는 원료의약품 80%를 수입에 의존하는 시장이다. 전체 의약품 비용 지출 32%를 항체의약품 비용으로 사용하고 있어 정부 의료 재정 부담이 큰 것으로 알려졌다. 또한 브라질 의약품시장 80%가 연방정부와 주정부 입찰시장이기 때문에 바이오시밀러 시장 진출에 매우 유리한 상황이라고 셀트리온 측은 설명했다.
셀트리온 관계자는 “유럽 등 의료 선진국과 마찬가지로 브라질도 의료비 재정 문제 해결을 위해 비싼 오리지널 의약품을 동일한 안전성과 효능을 인정받은 바이오시밀러로 대체하려는 요구가 높다”며 “유럽에서 빠른 속도로 시장점유율을 높여가고 있는 허쥬마가 브라질을 시장으로 중남미 전 지역 환자들에게 조기에 선보일 수 있도록 최선을 다할 것”이라고 말했다.
한편 브라질 내 허쥬마 유통 파트너사인 비옴(Biomm)은 현지에서 가장 큰 제약기업이다. 규제당국과 커뮤니케이션 역량이 우수한 것으로 알려졌으며 이를 통해 허쥬마의 시장 조기 진입에 전력을 다한다는 입장이다. 특히 브라질은 중남미 국가 가운제 제품 허가 기준이 까다롭고 엄격한 편에 속하는 국가로 브라질 당국 허가 상황이 주변국에 영향을 미칠 수 있다. 이에 따라 이번 판매 허가 승인이 중남미 시장 확대 가속화에 힘을 보탤 것으로 셀트리온은 기대하고 있다.
동아닷컴 김민범 기자 mbkim@donga.com
비즈N 탑기사
 백일 아기 비행기 좌석 테이블에 재워…“꿀팁” vs “위험”
백일 아기 비행기 좌석 테이블에 재워…“꿀팁” vs “위험” 최저임금 2만원 넘자 나타난 현상…‘원격 알바’ 등장
최저임금 2만원 넘자 나타난 현상…‘원격 알바’ 등장 “배우자에게 돈 보냈어요” 중고거래로 명품백 먹튀한 40대 벌금형
“배우자에게 돈 보냈어요” 중고거래로 명품백 먹튀한 40대 벌금형 이렇게 63억 건물주 됐나…김지원, 명품 아닌 ‘꾀죄죄한’ 에코백 들어
이렇게 63억 건물주 됐나…김지원, 명품 아닌 ‘꾀죄죄한’ 에코백 들어 상하이 100년간 3m 침식, 中도시 절반이 가라앉고 있다
상하이 100년간 3m 침식, 中도시 절반이 가라앉고 있다- 김지훈, 할리우드 진출한다…아마존 ‘버터플라이’ 주연 합류
- “도박자금 마련하려고”…시험장 화장실서 답안 건넨 전직 토익 강사
- 몸 속에 거즈 5개월 방치…괄약근 수술 의사 입건
- 일본 여행시 섭취 주의…이 제품 먹고 26명 입원
- “1인 안 받는 이유 있었네”…식탁 위 2만원 놓고 간 손님 ‘훈훈’
 1인 가구 공공임대 ‘면적 축소’ 논란…국토부 “면적 기준 폐지 등 전면 재검토”
1인 가구 공공임대 ‘면적 축소’ 논란…국토부 “면적 기준 폐지 등 전면 재검토” 삼성, 세계 첫 ‘올인원 AI PC’ 공개
삼성, 세계 첫 ‘올인원 AI PC’ 공개 “인구감소로 집값 떨어져 노후 대비에 악영향 줄수도”
“인구감소로 집값 떨어져 노후 대비에 악영향 줄수도” [머니 컨설팅]사적연금 받을 때 세금 유불리 따져봐야
[머니 컨설팅]사적연금 받을 때 세금 유불리 따져봐야 “만원으로 밥 먹기 어렵다”…평균 점심값 1만원 첫 돌파
“만원으로 밥 먹기 어렵다”…평균 점심값 1만원 첫 돌파- 고금리-경기침체에… 개인회생 두달새 2만2167건 역대 최다
- “한국판 마리나베이샌즈 막는 킬러규제 없애달라”
- 직장인 1000만명 이달 월급 확 준다…건보료 ‘20만원 폭탄’
- 엘리베이터 호출서 수령자 인식까지… ‘배송 로봇’ 경쟁 본격화
- 연체 채권 쌓인 저축銀, 영업 축소… 수신잔액 26개월만에 최저










![[단독]삼성전자 900명, 연봉 5.1% 인상 거부… 계열 7곳, 노사현황 긴급보고 [단독]삼성전자 900명, 연봉 5.1% 인상 거부… 계열 7곳, 노사현황 긴급보고](https://dimg.donga.com/a/102/54/90/1/wps/ECONOMY/FEED/BIZN/124623558.2.thumb.jpg)